关键词 |
福州GMP认证,GMP认证 |
面向地区 |
全国 |
GMP认证申请条件
GMP验厂咨询:不是任何企业都可以申请GMP认证,企业在申请定要做一些验厂咨询,多了解一些有关GMP验厂的知识,或者找的验厂辅导公司,做一次验厂辅导。
企业要申请GMP认证,具备下列5个条件:
(一)领有公司执照或商号之营利事业登记证者。
(二)领有经济部工厂登记证,并载有申请认证之产品项目者。
(三)符合现行食品有关法令、食品工厂GMP通、专则及本规章有关规定者。
(四)从事分装或改装产品之厂商,得申请食品GMP认证,惟其分装或改装前之产品应先取得食品GMP认证。
(五)加工层次轻微之产品,得视同分装或改装产品。如判定困难时,得提请食品GMP技术会研议。
以上5点是企业具备的,也是GMP验厂通过的先决条件。
创思维的服务宗旨“辅导+良好人脉”双确保工厂通过验厂,专为工厂解决验厂中遇到的各种难解之题;强大的顾问团队,的服务口碑,验厂关系通全国、可提前安排审核,现场、审核时间查询、率; 选择创思维-任何原因导致验厂不通过,我们负责到底!
GMP认证审核程序
1 、职责与权限
1.1省、自治区、直辖市品监督负责该辖区品生产企业品 GMP 认证申报资料的初审及日常监督管理工作。
2 、认证申请和资料审查
2.1 申请单位须向所在省、自治区、直辖市品监督管理部门报送《品 GMP 认证申请书》,并按《品 GMP 认证管理办法》的规定同时报送有关资料。省、自治区、直辖市品监督管理部门应在收到申请资料之日起 20 个工作日内,对申请材料进行初审,并将初审意见及申请材料报送品监督司。
2.2 认证申请资料经局司受理、形式审查后,转交局认证中心。
2.3 局认证中心接到申请资料后,对申请资料进行技术审查。
2.4 局认证中心应在申请资料接到之日起 20 个工作日内提出审查意见,并书面通知申请单位。
3 、制定现场检查方案
3.1 对通过资料审查的单位,应制定现场检查方案,并在资料审查通过之日起 20 个工作日内组织现场检查。检查方案的内容应包括日程安排、检查项目、检查组成员及分工等。在资料审查中发现并需要核实的问题应列入检查范围。
3.2 局认证中心负责将现场检查通知书发至被检查单位,并抄送其所在地省级品监督管理部门、检查组成员所在单位和局司。
3.3 检查组一般不超过 3 人,检查组成员须是品监督品 GMP 检查员。在检查组组成时,检查员应回避该辖区品 GMP 认证的检查工作。
4 、现场检查
4.1 现场检查实行组长负责制。
4.2 省级品监督管理部门可选派一名负责品生产监督管理的人员作为观察员参加辖区品 GMP 认证现场检查。
4.3 局认证中心负责组织 GMP 认证现场检查,并根据被检查单位情况派员参加、监督、协调检查方案的实施,协助组长草拟检查报告。
4.4 会议内容包括:介绍检查组成员;声明检查注意事项;确认检查范围;落实检查日程;确定检查陪同人员等。检查陪同人员是企业负责人或生产、质量管理部门负责人,熟悉品生产全过程,并能准确解答检查组提出的有关问题。
4.5 检查组须严格按照检查方案对检查项目进行调查取证。
4.6 综合评定检查组须按照检查评定标准对检查发现的缺陷项目进行评定,作出综合评定结果,拟定现场检查的报告。评定汇总期间,被检查单位应回避。
4.7 检查报告须检查组全体人员签字,并附缺陷项目、尚需完善的方面、检查员记录、有异议问题的意见及相关资料等。
4.8 未次会议检查组宣读综合评定结果。被检查单位可安排有关人员参加。
4.9 被检查单位可就检查发现的缺陷项目及评定结果提出不同意见及作适当的解释、说明。如有争议的问题,必要时须核实。
4.10 检查中发现的不合格项目及提出的尚需完善的方面,须经检查组全体成员及被检单位负责人签字后,双方各执一份。
4.11 如有不能达成共识的问题,检查组须作好记录,经检查组全体成员及被检单位负责人签字后,双方各执一份。
5 、检查报告的审核
局认证中心须在接到检查组提交的现场检查报告及相关资料之日起 20 个工作日内,提出审核意见,送品监督司。
药品GMP认证是国家依法对药品生产企业(车间)和药品品种实施GMP监督检查并取得认可的一种制度。虽然国际上药品的概念包括,但只有中国和澳大利亚等少数几个国家是将人用药GMP和GMP分开的。
正确理解新版GMP相关要求
许多医药企业日益感到新版GMP认证之路的艰难。其中,相当部分的中小医药企业生产线较少,缺乏对法规变化的风险预测,其厂房设计和定期改造升级工作没有形成制度性规定,这些造成其在新版GMP大限之前进行长周期的改造任务。然而,停产面临丧失市场的威胁,而不停产面临出局威胁。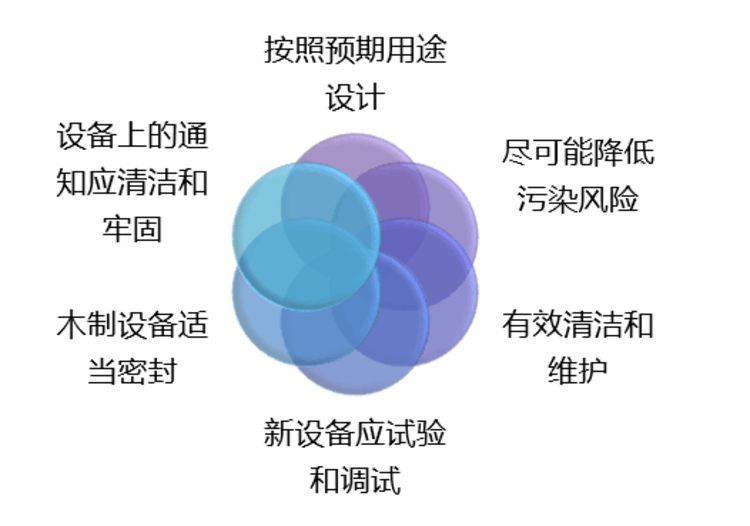
办理程序:
(一)申请:
申请人向省政务大厅食品药品监督管理局窗口提交《药品GMP认证申请书》(一式两份)及申请书电子文档,并附相关材料。
(二)受理:
申请材料经省政务大厅食品药品监督管理局窗口形式审查符合要求的,予以受理,出具受理通知书;申请材料不或者不符合形式审查要求的,5个工作日内发给申请人《补充材料通知书》;不予受理的出具《不予受理通知书》。
(三)现场检查:
经形式审查符合要求的转入技术审查,技术审查符合要求的安排现场检查。技术审查需要补充材料的,一次性书面通知申请企业。企业应在2个月内报送,逾期未报的中止认证工作。
(四)审查:
省食品药品监督管理局对现场检查报告进行审核和审批,符合认证标准的报国家食品药品监督管理局予以公告,公告无异议的,颁发《药品GMP认证审批件》和《药品GMP证书》,公告有异议的,组织调查核实。对不符合药品GMP认证标准要求的,且无法通过限期改正达到标准的,发给《药品GMP认证审批意见》;可以责令企业限期改正的,向被检查企业发整改通知书,整改的时期为6个月。企业在期限内改正完毕,提交改正报告,符合要求的派检查组再次进行现场检查。经再次现场检查,符合药品GMP认证标准,颁发《药品GMP认证审批件》和《药品GMP证书》;仍不符合的,发给《药品GMP认证审批意见》。
药品生产企业被吊销、缴销《药品生产许可证》或者被撤消、注销生产范围的,其相应的《药品GMP证书》由原发证机关收回。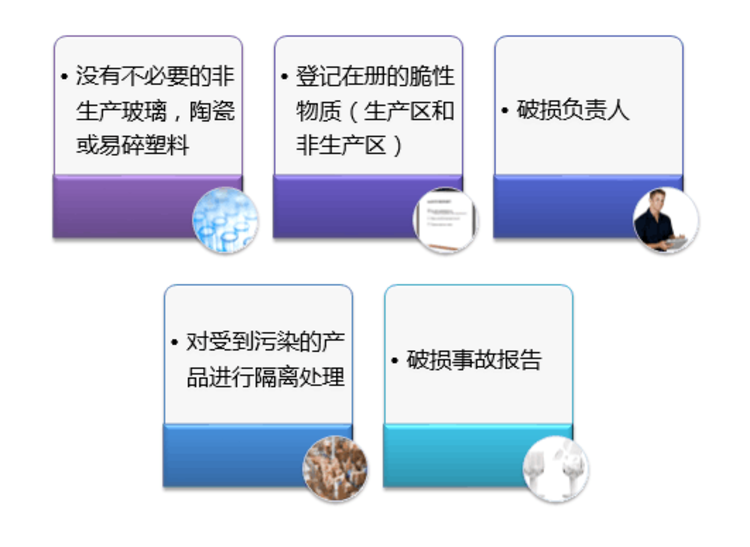
GMP认证是Good Manufacturing Practices的缩写,是一种国际标准,旨在食品和药品的制造安全可靠,质量可控。GMP认证是制药厂、食品厂和医疗器械等企业要取得的认证,以确保生产的过程和产品质量。
关于汉墨咨询
厦门汉墨企业管理咨询有限公司是经福建省厦门市工商局批准并注册登记的具有法人资格的综合管理咨询公司。公司具有丰富的培训咨询人才资源并组建了各个管理模块的培训咨询团队,致力于通过培训或咨询帮助企业解决管理困惑,如:体系认证培训与咨询、社会责任验厂培训与咨询、品质管理培训与咨询、现场管理培训与咨询,精益生产项目辅导、企业管理诊断等。公司始终坚持“从实际出发,着眼于未来”的宗旨,为选择了我们公司的客户提供从未来需求考虑的符合企业实际的培训咨询方案。
提供以下认证及培训咨询项目(包括但不限于):
1、认证与验厂(质量、环境、安全、食品安全、森林、信息安全、社会责任、回收、有机、反恐等):ISO9001(ISO9000)质量管理体系认证、ISO14001、ISO45001、ISO22000、BRC、IFS、HACCP、SQF、FSSC22000、IATF16949、ISO13485、QC080000、ISO27001、ISO20000、ISO50001、ISO22716、GMP、GB/T50430、FSC、产品认证、绿色产品认证、GAP良好农业规范认证、GRS回收标志认证、GOTS、OCS、RCS、BSCI、SEDEX、SA8000、ITSS信息技术服务标准评审、绿色产品认证、CMMI软件能力成熟度模型集成评估、CCRC信息安全服务资质认证、CE认证、ISCC可持续性国际碳认证计划、蓝色标志标准(BluesignStandard)认证、HIGG可持续发展工具、SLCP社会劳工整合评估方案、CMA实验室资质认定、CNAS检验检测机构资质办理、知识产权管理体系认证、服务管理体系认证、3A信用评价办理、生产许可证(SC)办理、环保产品认证、安全生产标准化辅导、两化融合管理体系评定、环境标志(十环)认证、绿色工厂认证、内审员培训等。
2、管理培训:管理自我(以客户为中心、情绪管理、执行力、个人行为特征、自我认知),管理业务(设备管理、现场管理、质量管理、采购管理、大客户管理、项目管理、精益管理),管理他人(MTP中高层管理能力提升、目标与计划管理、以经营为导向的绩效、团队管理、冲突管理、辅导下属)等。
3、管理咨询:组织架构梳理及人才战略、领导力测评与发展服务、培训管理体系搭建、企业文化梳理与落地等。
4、其他服务:企业科技政策项目申报服务(高新技术企业认定、专精特新、研发费用等补贴申报)、财务代理记账、知识产权服务。
您有任何疑问,请随时与我们联系!
————— 认证资质 —————